正常排卵机制 | |
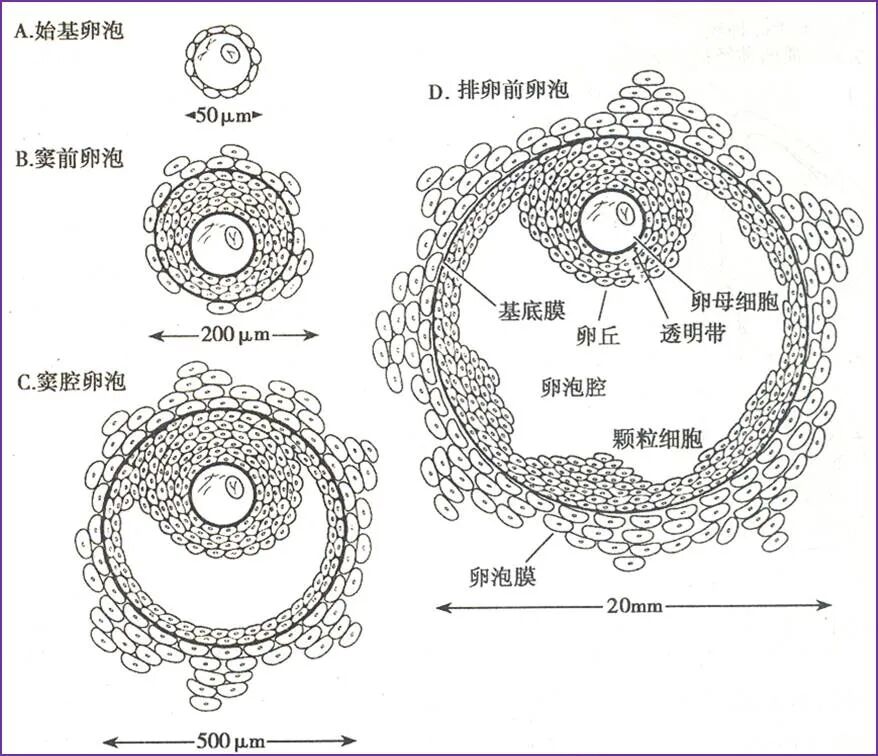
卵原细胞、颗粒细胞及卵泡膜细胞来源 | 胚胎早期由卵黄囊内胚层迁移到中肾的原始生殖细胞与卵巢内网状系统的网状细胞接触与并置,这种接触与并置不依赖促性腺激素与甾体激素的影响,两者分化为卵原细胞与前颗粒细胞。卵原细胞发生减数分裂,形成初级卵母细胞,其周围的颗粒细胞呈放射状排列,通过一层基膜与周围基质分开。卵泡基膜外的基质细胞形态呈纺锤状,核的致密度下降,形成卵泡膜细胞。同时颗粒细胞膜上出现缝隙连接和多种激素受体,继之,在两层以上颗粒细胞最内层与卵母细胞之间的物质沉淀形成透明带,卵泡之间的间充质组成卵巢基质。卵泡生长是在卵母细胞、颗粒细胞、卵泡膜细胞、卵巢基质相互作用下发生的。 |
GnRH神经元与HPO轴 | GnRH神经元作为HPO轴的中枢,并非直接接受雌激素、孕激素的反馈,雌孕激素的反馈通过KNDy、Kisspeptin神经元产生神经介质调控GnRH产生的振幅和脉冲频率,进而发挥HPO轴的中枢作用。编码GnRH前体蛋白的基因位于8号染色体短臂上,经转录、翻译、翻译后加工,再在胞质内经酶作用裂解为十肽物质的GnRH,储备于囊泡内,脉冲式分泌GnRH,同时分泌催乳素抑制素(PIH)和多巴胺。除下丘脑、垂体和卵巢激素之间的相互调节外,激活素-抑制素-卵泡抑素系统也参与对月经周期的调节。 |
卵泡生长发育 | 1、开始生长期:原始卵泡由停留于减数分裂双线期的初级卵母细胞被单层梭形前颗粒细胞包绕而形成。卵泡的发育始于原始卵泡到初级卵泡的转化(启动募集),其自主发育过程需9个月以上。 2、持续生长期:窦前卵泡发育包括初级卵泡和次级卵泡,窦状卵泡发育经历募集、选择及优势化。从窦前卵泡发育至成熟卵泡需经历持续生长期和指数生长期。持续生长期(1~4级卵泡),需60日。 3、指数生长期:指数生长期(5~8级卵泡),需25日。卵泡生长的最后阶段约需15日,是月经周期的卵泡期。排卵前卵泡为卵泡发育的最后阶段,为成熟卵泡。卵泡发育前后跨越了3个月经周期。 |
AMH | 属于TGF-β超家族,在小于6mm的生长卵泡中表达,通过降低卵泡对FSH的敏感性抑制卵泡生长,是目前研究发现的唯一能抑制原始卵泡募集的细胞因子,参与控制离开原始卵泡池的卵泡比例,同时可抑制原始卵泡启动,在优势卵泡选择中也发挥作用。 |
募集 | 前一卵巢周期的黄体晚期及本周期卵泡早期,通过E2负反馈,血清FSH水平及其生物活性增高,超过一定阈值后,卵巢内有一组窦状卵泡簇进入生长发育轨道。这里指周期募集,对Gn有反应,未募集的卵泡发生凋亡。目前已知的三个卵泡募集活化剂是:颗粒细胞产生的kit配基、膜细胞产生的骨形态发生蛋白-7(BMP-7)和血浆中的FSH水平。 |
选择 | “FSH阈值”和“FSH窗”学说,月经周期的第7天左右,募集的卵泡簇受FSH影响,开始发育,其中个别卵泡FSH受体含量丰富,颗粒细胞中分裂指数高,FSH阈值最低,优先发育成为优势卵泡,卵泡腔充盈,其余的卵泡逐渐退化闭锁。 |
优势化 | 优势卵泡可能通过内分泌或旁/自分泌的方式,产生一种对其它卵泡发育不利的环境,包括产生抑制素及分泌E2发挥负反馈作用,使FSH下降,抑制未被选择卵泡的发育。优势卵泡的颗粒细胞上出现了LH受体,LH补充了FSH的不足进一步促进优势卵泡的生长发育至排卵。同时E2分泌对其他器官发挥作用,使各种生物过程同步化或协调化,为排卵、受精及胚胎种植作准备。 |
排卵 | 排卵过程经历卵泡体积增大、卵母细胞核成熟、卵丘细胞松散、排卵柱头的形成4个阶段,受到激素及肽类生长因子的调节。整个排卵过程中涉及甾体激素、前列腺素、肿瘤坏死因子α(TNF-α)、蛋白水解酶、胶原酶、基质金属蛋白酶(MMP)和环氧化酶等的参与。 1、当成熟卵泡分泌的E2峰≥200pg/ml时,对下丘脑形成正反馈,GnRH大量释放,继而引起垂体释放促性腺激素,出现LH/FSH峰。LH峰促使初级卵母细胞完成第一次减数分裂,排出第一极体,成熟为次级卵母细胞,卵泡黄素化,产生少量孕酮。 2、LH/FSH峰与孕酮协同,激活卵泡液内蛋白溶酶活性,使卵泡壁隆起尖端部分的胶原消化形成排卵孔。颗粒细胞合成前列腺素,卵泡液中前列腺素显著增加,卵泡膜外层的平滑肌收缩,卵泡排出。两侧卵巢轮流排卵,也可由一侧卵巢连续排卵。 |
雌激素合成:两细胞-两促性腺激素学说 | |
颗粒细胞 | 卵母细胞与颗粒细胞通过缝隙连接双向转运营养、生长因子和其他分子支持卵母细胞生长。颗粒细胞间形成Call-Exner小体,最后形成卵泡腔。 |
卵泡膜细胞 | 来自于微动脉的卵泡血管在邻近基膜处终止于环形网状微血管,形成卵泡内膜。卵泡内膜细胞合成黄体生成素(LH)受体,同时具备了合成类固醇激素的能力。卵泡内膜细胞形成富含脂质的胞质空泡,整个卵泡膨胀,压迫周围基质形成卵泡外膜。 |
FSH与LH | 垂体前叶分泌卵泡刺激素(FSH)和黄体生成素(LH),属糖蛋白激素,含α与β两个亚单位肽链,α-肽链结构相同,而β-肽链各有特征。FSH与LH的生成与释放受下丘脑促性腺激素释放激素(GnRH)直接调控,但因雌激素和抑制素选择性抑制FSH的分泌,不抑制LH分泌,所以GnRH对FSH合成的总体控制要比对LH的作用小。垂体促性腺激素分泌存在“双池理论”,第一池代表垂体对GnRH的敏感性,第二池代表垂体对GnRH反应的储备。在卵泡发育过程中,LH刺激膜细胞合成甾体激素,为颗粒细胞芳香化提供雄激素的底物,排卵前LH峰能促使卵母细胞最终成熟及排卵。 |
雌激素 | 多种羟化酶及芳香化酶参与颗粒细胞合成雌激素,排卵前以Δ5途径合成,排卵后以Δ4和Δ5两条途径合成。首先LH+卵泡膜细胞上LH受体利用来自血液循环中的胆固醇在卵泡膜细胞内形成睾酮和雄烯二酮,然后睾酮和雄烯二酮透过细胞膜进入颗粒细胞。继而FSH+颗粒细胞上的FSH受体活化芳香化酶,促进睾酮和雄烯二酮分别转化为雌二醇和雌酮。 |
孕激素 | 孕酮的合成通过Δ4途径,卵泡期卵泡不分泌孕酮,排卵前成熟卵泡的颗粒细胞在LH排卵峰的作用下黄素化,开始分泌少量孕酮,排卵后黄体分泌孕酮逐渐增加,至排卵后7~8日黄体成熟时,分泌量达最高峰。 |
雄激素 | 女性体内雄激素主要源于肾上腺,少量由卵巢合成和分泌。卵泡腔形成的时候,卵泡内膜细胞上也开始表达LH受体和胰岛素受体,在LH和胰岛素刺激下,卵泡膜细胞及卵巢间质细胞合成雄激素,包括睾酮、雄烯二酮和脱氢表雄酮。 |
前列腺素 | 在排卵前颗粒细胞中COX-2的诱导下,LH刺激卵泡合成前列腺素,前列腺素E2被认为是与排卵有关的关键性前列腺素。 |
激活素-抑制素-卵泡抑素系统 | 是卵巢分泌的多肽激素,与HPO轴一起共同参与月经及卵泡发育调节。激活素在卵巢局部通过自分泌作用增强垂体的GnRH受体数量,提高垂体对GnRH的反应性,从而刺激FSH产生、抑制催乳素、ACTH与生长激素反应。抑制素选择性抑制垂体FSH产生,增强LH活性。卵泡抑素也称FSH抑制蛋白,主要功能是通过自分泌/旁分泌作用,抑制FSH产生,降低FSH对GnRH的反应性,降低激活素的活性。 |
拾卵与受精 | 输卵管伞部捡拾卵子(次级卵母细胞、透明带、放射冠、小部分卵丘内的颗粒细胞)进入输卵管,在输卵管内与获能的精子相遇,卵子迅即完成第二次减数分裂形成卵原核,排出第二极体。卵原核与精原核融合,核膜消失,染色体相互混合,形成二倍体的受精卵,完成受精过程。受精后第4日形成早期囊胚进入宫腔,第5~6日囊胚孵化,第6~7日着床。 |
排卵障碍机制 | |
下丘脑性无排卵:器质性因素所致的功能衰竭及功能性因素 | |
低促性腺激素性性腺功能减退 | 下丘脑分泌GnRH不足或垂体分泌促性腺激素不足,导致原发性闭经、性腺功能低下、第二性征发育不良等,约50%的患者已鉴定出超过25种不同的致病基因。约50%的患者合并不同程度的嗅觉缺陷,嗅基板的神经元发育异常或GnRH神经元移行异常是病因之一,称为卡尔曼综合征(Kallmann syndrome,KS)。 |
Frohlich综合征 | 肥胖性生殖无能综合征:肥胖、性器官发育不良和尿崩等为其特征,下丘脑部位肿瘤或炎症为常见原因,GnRH分泌障碍,导致FSH及LH分泌减少,性腺功能低下,第二性征发育不良。患者饱感丧失、食欲增加、胰岛素分泌亢进、脂肪代谢紊乱而形成肥胖。 |
Laurence-Moon-Biedl综合征 | 劳-蒙-毕综合征:肥胖、多指(趾)畸形、视网膜色素变性、性腺发育不全、智力发育迟缓等表现,多为常染色体隐性遗传。 |
肥胖 | BMI≥30,糖尿病及体内高糖状态影响卵子及胚胎质量。肥胖可抑制性激素结合球蛋白,使游离雄激素增多;脂肪组织可储存类固醇激素,将雄激素转变为雌激素,通过反馈致使促性腺激素的异常分泌,引起不排卵及月经异常。 |
过度消瘦 | 神经性厌食症或肿瘤:营养不良抑制下丘脑-垂体-卵巢轴,FSH及LH水平较低,E2较低,月经紊乱,甚至闭经,属功能性下丘脑性闭经。患者妊娠率低,但意外妊娠率常增加。 |
剧烈运动 | 排除性诊断,功能性下丘脑闭经。基础代谢率急剧增加,GnRH释放受抑制使LH释放受抑制,低卵巢功能、雌激素低下,饮食失调、月经紊乱、骨丢失。 |
精神心理因素 | 应激压力导致血浆中皮质醇水平升高,影响FSH的释放及排卵过程,引起卵母细胞在减数分裂过程中纺锤体形成受阻,导致非整倍体发生率增高。假孕是一种典型的神经-内分泌疾病,抑郁是发生假孕的关键。 |
其他因素 | 颅脑外伤损伤下丘脑,导致垂体功能不足,并伴有高泌乳素血症。抗精神病药物、避孕药、长效孕激素等可能引起下丘脑功能障碍。 |
垂体功能障碍性无排卵 | |
高泌乳素血症 | 泌乳素的分泌主要受到下丘脑释放入门脉循环的多巴胺(PRL抑制因子)的抑制性调节,与外周激素没有直接和间接的负反馈。高泌乳素血症对下丘脑-垂体-卵巢轴中3个部位均有抑制作用,导致卵泡发育不良及排卵障碍,主要表现为月经异常、溢乳和不孕。 |
席汉综合征 | 继发于产后出血性休克引发的垂体前叶急性缺血坏死,导致垂体功能不足综合征,为垂体功能低下常见原因。 |
空蝶鞍综合征 | 蛛网膜下腔疝入垂体窝,压迫垂体,使之变形、功能障碍、萎缩、蝶鞍扩大。头痛是最常见的症状,垂体功能不足和内分泌障碍。 |
卵巢性无排卵 | |
多囊卵巢综合征(PCOS) | 在多个基因和多重环境因素作用下,由HPO轴、肾上腺轴等体内多种内分泌系统功能紊乱所引起的临床异常表现综合征。LH过量分泌:刺激卵泡膜细胞雄激素合成限速酶-细胞色素P45017α羟化酶的活性,使雄激素产生增多,而过高的雄激素又可促进LH释放,从而形成PCOS雄激素过多的恶性循环;抑制胰岛素受体β酪氨酸磷酸化引起胰岛素抵抗、高胰岛素血症和高雄激素血症;促使颗粒细胞-卵泡膜细胞过早黄素化,抑制窦卵泡的发生、发育及排卵;FSH-颗粒细胞轴功能减退使FSH浓度降低,不足以使卵泡发育成熟,使得窦前卵泡不断发育成窦状卵泡,在卵巢内集聚形成卵巢多囊样改变。FSH浓度降低引起颗粒细胞芳香化酶活性降低,雌激素虽持续分泌,但处于低浓度状态,不能降至最低点,可反馈抑制垂体FSH分泌,不能形成排卵前雌激素高峰以诱发LH峰和排卵,也导致卵巢多囊样改变;同时芳香化酶活性降低抑制卵泡内雄激素转化为雌激素,从而雄激素集聚在卵巢内引起卵泡凋亡和闭锁,无优势卵泡发育,无排卵。 |
未破裂卵泡黄素化综合征(LUFS) | LH峰出现后2天,卵泡仍继续生长,泡膜细胞和颗粒细胞黄素化,伴有血清孕酮水平升高,且周期中生殖激素水平与正常排卵妇女相似。但LH峰不足,孕酮分泌减少,局部纤溶酶原激活剂活性低下,降低纤维蛋白的溶解和卵泡壁的自身消化作用,卵泡的成熟、破裂及卵子排出受到阻碍。PCOS、高LH、高雄激素、高催乳素血症、盆腔粘连、子宫内膜异位症、促排卵药、非甾体类抗炎药等可导致LUFS。 |
高促性腺激素性性腺功能减退 | 主要表现为性激素缺乏,LH和FSH升高。性腺先天性发育不全:特纳综合征、46,XX单纯性腺发育不全、46,XY单纯性腺发育不全(Swyer综合征)、XO/XY性腺发育不全等。酶缺失影响性激素合成。放化疗、半乳糖血症、腮腺炎、自身免疫性疾病等引起卵巢功能减退。 |
卵巢抵抗综合征(ROS) | 又称卵巢不敏感综合征,卵巢大小正常,有较多的原始卵泡,而无卵泡生长,对内源性或外源性Gn无反应,病因不明确,可能与Gn的受体突变有关。主要临床表现为原发性闭经,Gn水平升高,特别是FSH水平升高(20~40U/L),AMH接近同龄女性的平均水平。 |
卵巢早衰(POF) | POF指女性40岁以前,排除妊娠,至少闭经6个月,间隔1个月至少2次基础FSH>40IU/L,雌激素水平减低<185pmol/L(50pg/ml),AMH<8pmol/L(1.1ng/ml),并伴有不同程度的低雌激素症状,是早发性卵巢功能不全(POI)的终末阶段,另一个疾病状态是卵巢储备功能减退(DOR)。不明原因POF又称特发性POF,在POF患者中约占90%。 |
其它内分泌疾病对排卵的影响 | |
甲减 | 全身性低代谢综合征,TSH增加引起高泌乳素血症和促性腺激素释放激素分泌节律改变,导致LH峰延迟和黄体功能不足。甲状腺素影响雌激素、孕激素及SHBG的合成,导致垂体水平的异常反馈,青春期前可有性发育障碍,使青春期延迟,生育期则出现月经过少、稀发,排卵功能障碍,甚至闭经。 |
甲亢 | 导致不孕的机制尚不明确,甲亢使SHBG合成、雌激素代谢、雄激素向雌激素的转化、促性腺激素对GnRH的反应性和基础促性腺激素水平增加,但甲亢妇女一般能维持排卵。甲状腺素分泌与释放增加,子宫内膜过度增生,月经过多、过频。当甲亢进一步加重时,甲状腺素的分泌、释放及代谢等过程受到抑制,临床表现为月经稀发、月经减少,甚至闭经。 |
肾上腺功能异常 | 肾上腺分泌糖皮质激素主要调节糖、蛋白质及脂肪的代谢,盐皮质激素主要调节钠、钾等电解质的代谢,性激素主要作用是促进毛发、骨骼、肌肉生长及第二性征发育等。肾上腺皮质是女性雄激素的主要来源,酶缺陷可引起皮质激素合成受阻,中间产物转而合成过量雄激素,负反馈抑制下丘脑,并对抗雌激素作用,使卵巢功能受抑制。 |
胰腺功能异常 | 胰岛素依赖型糖尿病患者常伴有卵巢功能低下,在胰岛素抵抗的高胰岛素血症患者中,过多的胰岛素将促进卵巢产生过多雄激素,从而发生高雄激素血症,导致月经失调,甚至闭经。 |
1、《人类卵子学》,主编 孙莹璞、相文佩
2、《不孕不育专家推荐诊疗方案》,主编 陈子江、刘嘉茵
3、《妇产科学》第10版,主编 孔北华、马丁、段涛