一、发病机制
二、临床表现
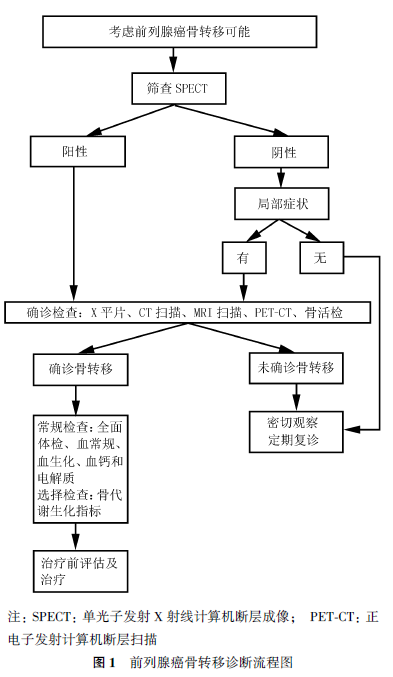
三、诊断
四、治疗
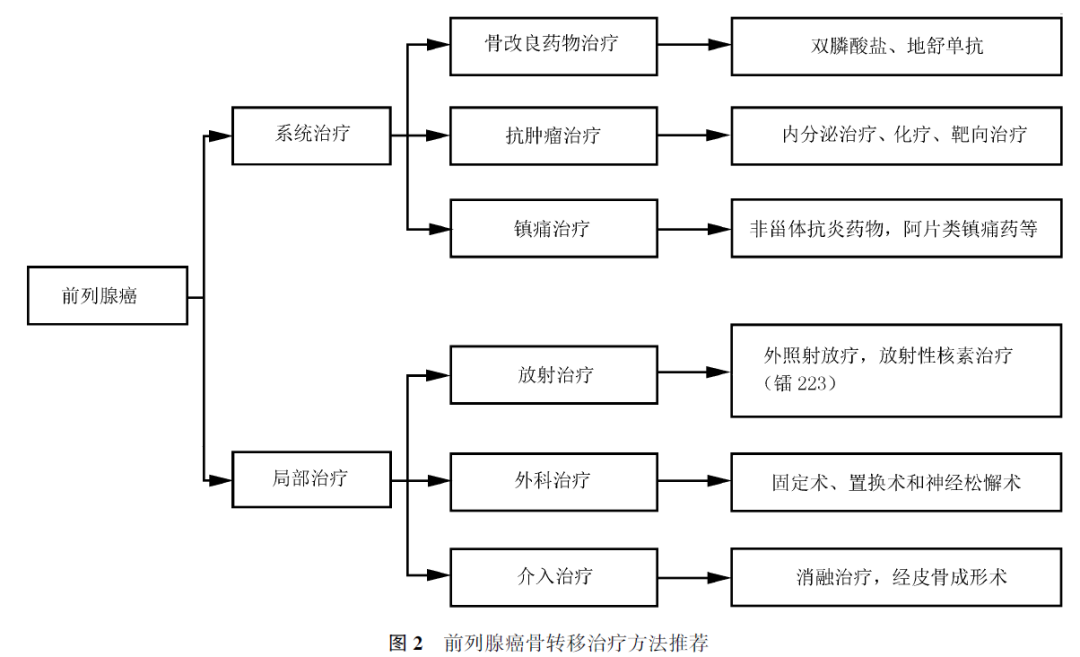
(一)
骨改良药物治疗
(二)
抗肿瘤治疗
(三)
镇痛治疗
(四)
放射治疗
(五)
外科治疗
(六)
介入治疗
五、结语
共识专家组顾问
叶定伟(复旦大学附属肿瘤医院泌尿外科)
魏少忠(湖北省肿瘤医院泌尿外科)执笔专家
王弘恺(复旦大学附属肿瘤医院泌尿外科)
参与本次共识审定的专家(按姓氏汉语拼音字母排序)
边家盛(山东省肿瘤医院泌尿外科)
陈辉(哈尔滨医科大学附属肿瘤医院泌尿外科)
陈惠庆(山西省肿瘤医院泌尿外科)
郭剑明(复旦大学附属中山医院泌尿外科)
何朝宏(河南省肿瘤医院泌尿外科)
何立儒(中山大学附属肿瘤医院放疗科)
胡滨(辽宁省肿瘤医院泌尿外科)
金百冶(浙江大学医学院附属第一医院泌尿外科)
廖洪(四川省肿瘤医院泌尿外科)
刘畅(复旦大学附属肿瘤医院核医学科)
马琪(宁波市第一医院泌尿外科)
蒙清贵(广西医科大学附属肿瘤医院泌尿外科)
潘铁军(解放军中部战区总医院泌尿外科)
齐隽(上海交通大学医学院附属新华医院泌尿外科)
史本康(山东大学齐鲁医院泌尿外科)
涂新华(江西省肿瘤医院泌尿外科)
王海涛(天津医科大学第二医院泌尿外科)
王弘恺(复旦大学附属肿瘤医院泌尿外科)
魏强(四川大学附属华西医院泌尿外科)
魏少忠(湖北省肿瘤医院泌尿外科)
谢晓冬(解放军北部战区总医院泌尿外科)
邢金春(厦门大学附属第一医院泌尿外科)
叶定伟(复旦大学附属肿瘤医院泌尿外科)
张爱莉(河北医科大学第四医院泌尿外科)
朱刚(北京和睦家医院泌尿外科)
朱伟智(宁波市鄞州第二医院泌尿外科)
邹青(江苏省肿瘤医院泌尿外科)