陈善闻 刘东顺
一.摘要和速览
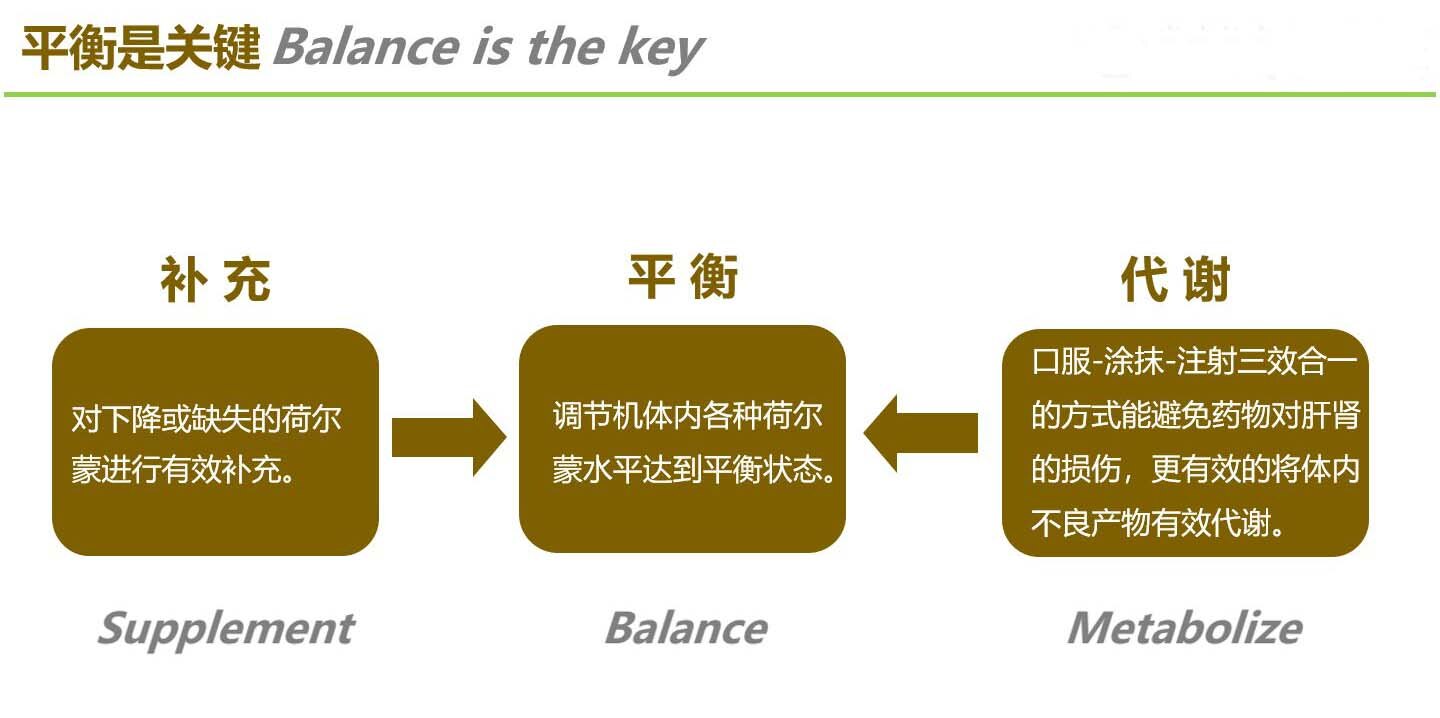
随着年龄的增长,睾酮水平会下降,其他荷尔蒙也会经常失去最佳平衡。
使用生物一致性荷尔蒙替代疗法恢复青春期的睾酮和其他荷尔蒙水平可以帮助维持整体健康。
大多数男人都知道睾酮对健康和(性)表现很重要,但许多人不知道维持其他荷尔蒙(如雌激素和DHEA)的健康水平也很重要。
本文将帮助您了解整体的荷尔蒙恢复,在适当的医疗护理,良好的饮食习惯和充足的运动结合下,如何为您的健康提供支持。
补充锌和白杨素可以帮助男性保持健康的荷尔蒙平衡。
保持平衡的荷尔蒙水平对整体健康至关重要。不幸的是,男性的睾酮水平随着年龄的增长而下降。大多数男性都知道睾酮对性功能很重要,但研究表明,睾酮对更多方面至关重要:维持认知功能和健康体重,改善胰岛素敏感性和葡萄糖代谢,促进心脏健康等等。此外,睾酮与雌激素的比值似乎是心脏病患者死亡率的一个重要指标。
睾酮水平受其他几种荷尔蒙和酶的影响,如DHEA(睾酮和雌激素的前体)、芳香化酶(一种将睾酮转化为雌激素的酶)和性激素结合球蛋白(SHBG)(一种结合睾酮的糖蛋白)。有些功能性的营养补充剂,如维生素D和锌,对支持健康的睾酮水平也很重要。

·年龄
·身体脂肪增多
·氧化损伤
·DHEA等前体水平下降
·营养不良,肝功能差
全面的荷尔蒙检测对于准确了解您的荷尔蒙平衡很有必要。 游离睾酮和总睾酮水平都很重要,雌激素水平也是决定比值的重要因素。 荷尔蒙水平在人与人之间会有很大的差异,因此有必要随着时间的推移重复检测,以确定荷尔蒙水平是下降还是变化。只有经过全面的检测后,才能决定荷尔蒙替代治疗是否是一个好的选择,并且只能在医疗保健专业人员的指导下进行。
不会。 截至撰写本文时,科学文献尚不支持高睾酮水平与前列腺癌风险增加之间的关联。
除了荷尔蒙替代治疗外,还有许多自然的方法来支持睾酮水平和健康的男性功能:
·锌。 锌对男性生殖功能的许多方面是必不可少的,从睾酮代谢到精子活力。
·DHEA。 作为睾酮的前体,健康的睾酮产生需要足够的DHEA水平。 DHEA水平随着年龄的增长而下降。
·蒺藜。 蒺藜(或刺藤)中的活性成分原薯蓣皂甙可能在体内转化为DHEA。 它被誉为催情剂,动物研究似乎证实了它增强性功能的能力。
·抗氧化剂。抗氧化补充剂,包括维生素A、E和硒,已经被证明能促进男性睾酮的产生。
·菊花提取物。这种生物类黄酮自然抑制芳香化酶,从而可能减少睾酮向雌激素的转化。 用胡椒碱(黑胡椒提取物)可提高其生物利用率。
·荨麻根。荨麻根中的木质素可能阻止SHBG结合睾酮,这可能会提高游离睾酮水平。 荨麻根常用于缓解良性前列腺增生(BPH)症状。
·吲哚-3-甲醇(I3C)。 在许多十字花科蔬菜中发现的I3C可能保护前列腺免受有害的雌激素代谢物的影响。
·臀果木。自1960年以来,臀果木在欧洲一直被用于缓解的BPH症状。臀果木可能会阻止睾酮转化为加重BPH的代谢物。
·锯棕榈。锯棕榈是一种很受欢迎的前列腺健康补充剂。 它的临床好处包括减少夜间尿急和减少排尿症状的不适。
·其他天然产品,如槲皮素、鱼油、玛咖、左旋肉碱、蛋白质等,可能有助于支持健康的睾酮水平和男性功能。
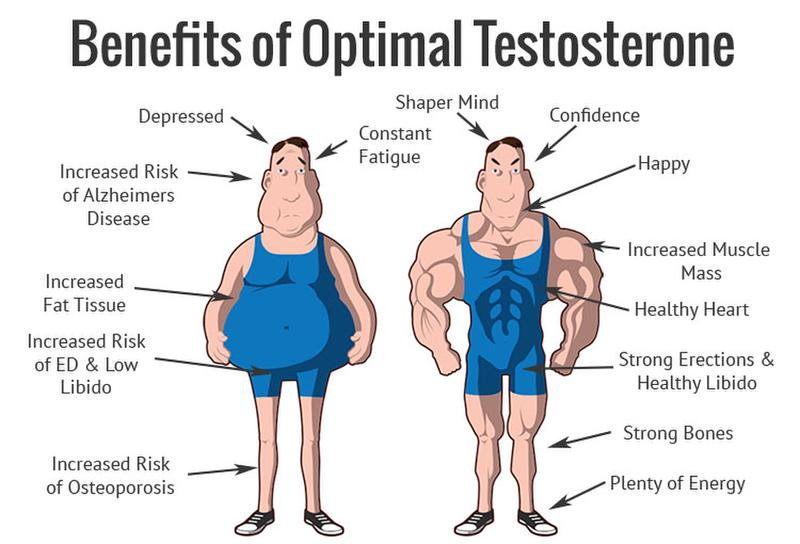
对于大多数的人来说,睾酮对男性性功能的重要性是显而易见的。 然而,新的研究强调了睾酮在维持年轻的神经结构、减轻抑郁以及为那些无论采用饮食和运动都无法减轻体重的人,减少脂肪方面起到关键作用。
最近的研究表明,男性低睾酮与代谢综合征、2型糖尿病、心血管疾病密切相关1,并且在七年期间,死亡率增加了近50%。2
在中年肥胖男性中,睾酮恢复到年轻的水平,会导致胰岛素敏感性增加,以及总胆固醇、脂肪量、腰围与动脉粥样硬化、糖尿病和代谢综合征相关的促炎细胞因子减少3-5。在患有心力衰竭的男性中,睾酮疗法还可以显著改善勃起功能及性功能,6或在没有严重压力的情况下进行体育锻炼的能力。7
脱氢表雄酮(DHEA)是一种由胆固醇产生的荷尔蒙,然后遵循两种途径之一,两者都涉及两步酶促转化,从而产生雌激素或睾酮。 因此,尽管DHEA不足以充分恢复衰老男性的睾酮水平,但DHEA水平可能在确定雌激素和睾酮的水平中起作用。
影响睾酮水平和睾酮与雌激素比值的最重要因素之一是芳香化酶。 芳香酶将睾酮转化为雌激素,进一步消耗游离睾酮水平,增加雌激素水平。
肥胖和相关的高胰岛素血症会抑制睾丸中的黄体生成素(LH)的作用,可显著降低循环睾酮水平,8即使是40岁以下的男性中也是如此。9此外,腹部脂肪量的增加与芳香化酶水平的增加有关。10
低睾酮和肥胖的恶性循环被描述为性腺机能减退/肥胖周期。 在这个周期中,低睾酮水平导致腹部脂肪增加,进而导致芳香化酶活性增加。 这增强了睾酮向雌激素的转化,从而进一步降低了睾酮,并增加了腹部脂肪的形成。11,12
血液中循环的大多数睾酮都与性荷尔蒙结合球蛋白(SHBG)(60%)或白蛋白(38%)结合%。 只有一小部分(2%)是未绑定的或“自由”(游离状态)——游离睾酮。13
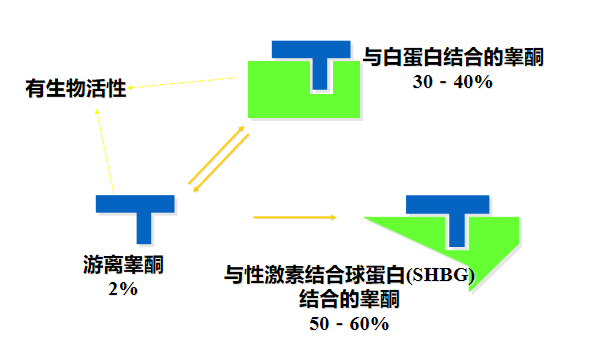
我们可以把总睾酮比喻成存在银行里的钱---钱是你的但是你不能随时随刻地拿到他们,他们被储存在银行里。另一方面,游离睾酮在血液中自由存在,可以与睾酮受体位点结合后被机体利用。我们可以把游离睾酮比喻成你口袋里的钱---你随时都可以使用他们。
睾酮与SHBG的结合比与白蛋白结合更紧密。14因此,只有白蛋白结合的睾酮和游离睾酮构成了睾酮的生物可利用形式,可通过靶组织并执行必需荷尔蒙的作用。13因此,睾酮的生物利用率受SHBG水平的影响。
男性衰老会增加芳香化酶活性,同时又会增加SHBG的生产。 最终结果是雌激素与睾酮的比率增加,总睾酮和游离睾酮水平降低。15正如下文将讨论的那样,平衡这一比率(雌激素与睾酮比率失衡)至关重要。
肝脏负责清除过量的雌激素和SHBG,肝脏功能的任何下降都会加剧荷尔蒙失衡,并损害健康的睾酮水平。 因此,衰老的男性也必须努力获得最佳的肝功能。
与年龄相关的睾酮水平降低的确切原因尚不清楚;这可能是多种因素的综合结果,包括:
·身体脂肪增加(特别是腹部脂肪,因此增加芳香化酶活性)
·对产生睾酮的组织的氧化损伤
·睾丸睾酮合成减少
·DHEA等前体分子水平下降
·营养状况及肝功能
睾酮水平下降的后果令人震惊。
睾酮通过多种方式影响脂肪细胞代谢和脂肪减少:通过阻断一种称为脂蛋白脂肪酶的关键酶来抑制脂肪储存,这种酶是摄取脂肪进入人体脂肪细胞所必需的;通过增加脂肪细胞膜上释放储存脂肪的特定受体的数量来刺激脂肪燃烧;提高胰岛素敏感性;促进肌肉纤维的生长;减少脂肪沉积。 所有这些作用促进增加瘦体重和减少脂肪量。16,17安慰剂对照试验表明,在老年男性中,不同疗程的睾酮治疗后,瘦体重显著增加,脂肪减少。 在这些研究中,睾酮水平低的参与者接受了12个月或更长时间的睾酮治疗后,身体成分发生了最大的有利变化。18
新的证据表明,维持年轻的睾酮水平可能有助于老年男性避免各种炎症介导的疾病,如动脉粥样硬化和关节炎。 睾酮通过强有力地抑制一种称为5-脂氧合酶的酶的活性,使参与合成信号分子白三烯的一种基本促炎途径平静下来。19白三烯是促炎性ω-6脂肪酸花生四烯酸的衍生物;这些分子是哮喘和支气管炎炎症发展的主要基础,在心血管疾病和糖尿病的病理过程中也起着重要作用。20,21
在一项涉及184名睾酮水平低的男性的研究中,18周的睾酮替代治疗抑制了炎症标志物,包括IL-1β、TNF-α和C反应蛋白。 此外,与接受安慰剂对照的男性相比,接受睾酮替代治疗的男性在体重、体重指数(BMI)和腰围方面显著下降。22腰围的减少表明睾酮减少了身体躯干周围的脂肪堆积;这一点特别重要,因为中央脂肪量大,并且与增加炎症性疾病的易感性和死亡率密切相关。23
睾酮治疗已被证明可以减轻体重,改善低睾酮水平的男性的健康措施。 在一项对471名患有性腺功能减退的肥胖男性进行的非随机登记研究中,患者选择接受十一酸睾酮注射(每12周1000毫克)或不接受治疗(对照组)。 在长达11年后,睾酮组的体重平均下降了23公斤(51磅,约占体重的20%),而对照组的体重增加了6公斤(13磅,约占体重的6%)。 睾酮治疗也与腰围减少13.3厘米有关,而对照组增加6.7厘米。 最后,睾酮可能对其他健康结果有积极的影响。 在对照组中,28%的男性发生心脏病发作,27%的男性发生中风;睾酮组没有心脏病发作或中风的报告。 与未服用睾酮者相比,服用睾酮者的死亡率也较低(8%对32%)。
骨的完整性取决于骨形成和骨吸收之间的平衡,这是由多种因素控制的-包括雌激素和睾酮水平。24,25在一项临床试验中,睾酮增加了老年男性的骨密度。26补充睾酮对肌肉代谢和力量也有积极的影响。27这种积极影响随着年龄的增长而不减。
良好老龄化的关键是乐观的人生观和参与社交和体育活动的能力。 然而,低水平的睾酮与抑郁和其他心理障碍有关。28更糟糕的是,许多传统的抗抑郁药抑制了性欲。 一些专家建议,睾酮治疗可以完全减少对抗抑郁药物的需求。29,30此外,睾酮治疗往往会增加幸福感。31
认知和警觉性也在一定程度上受睾酮对中枢神经系统的影响。32低睾酮水平已被证明与各种心理测试的得分较低有关,33据报道,在接受雄荷尔蒙(男性荷尔蒙)剥夺治疗前列腺癌的男性中也有类似的影响。34
睾酮还起到内源性神经保护剂的作用,能够支持神经元抵抗包括氧化应激在内的多种毒性损伤。35,36此外,睾酮已被证明可以减少β-淀粉样蛋白的积累,这是阿尔茨海默病的重要病理生理因素。37,38
睾酮可改善易患神经退行性疾病的大脑区域的神经元存活。 这可能解释了男性睾酮水平低与神经退行性疾病的关系。39,40研究表明,睾酮的损失发生在阿尔茨海默氏病诊断前5到10年。 这表明低睾酮水平是阿尔茨海默病的一个重要危险因素。41,42在一项对36名最近被诊断为阿尔茨海默病的男性的临床研究中,肌肉内睾酮治疗每两周200毫克,持续时间长达一年,与整体认知能力和关键视觉空间功能的改善有关。43
睾酮也与体内代谢功能有关。 具体来说,研究发现代谢综合征的严重程度,血浆脂肪过多,睾酮水平低与代谢综合征的严重程度呈负相关。代谢综合征的特点是腹部脂肪过剩、高胆固醇和高血压,这是心血管疾病的诱因之一。18,44一项临床研究表明,低睾酮水平的男性胰岛素抵抗水平是正常睾酮水平的两倍,90%符合代谢综合征的标准。45
男性低睾酮水平与糖尿病之间似乎也存在着反比关系。46与没有糖尿病史的男性相比,患有糖尿病的男性睾酮水平较低。47对1,413名男性进行的第三次全国健康和营养调查显示,男性最初的排名为在研究人员根据年龄,种族/民族和肥胖状况对结果进行了调整之后,游离或可生物利用的睾酮中,最低的三分之一患上糖尿病的几率是排名最高的三分之一患者的四倍。48
传统的观点认为,死于心脏病的男性多于女性,这与睾酮有关。但是,研究指出,实际上可能相反。睾酮水平低似乎与多种心血管危险因素有关,包括动脉粥样硬化脂质状况、胰岛素抵抗、肥胖和血栓形成倾向。49此外,最近的研究表明,低睾酮水平与心血管疾病发病率增加和男性死亡率之间存在明显的关系。2
与年轻男性相比,年长男性的雌二醇(雌激素的一种有效形式)比在体内循环的游离睾酮要多得多。 这些不断上升的雌激素和不断下降的雄荷尔蒙水平在前列腺中的定义更为明确。
随着年龄的增长,前列腺中雌激素水平显著升高,前列腺组织中雌激素水平在患有BPH的男性中甚至更高。50-52
一项重要的研究表明,在大多数情况下,睾酮对前列腺有益。在这项研究中,研究人员研究了一组参数低下或正常睾酮水平低的男性的多个参数,包括前列腺体积,前列腺特异性抗原(PSA)水平和下尿路症状.53在研究的207名男性中,有187名有反应有利于睾酮的治疗。
数以百万计的老年人患有睾酮水平低和胆固醇高的双重条件。传统的医生开降胆固醇药物来降低胆固醇,事实上,与年龄相关的胆固醇升高可能只是身体通过提供制造荷尔蒙所需的原材料来提高荷尔蒙水平的方法。54研究人员通过生物一致性荷尔蒙替代疗法成功地治疗高胆固醇水平。相信全面的检测以及仔细的身体检查对于发现老年男性的荷尔蒙失调至关重要。
老年男性所谓的“正常”睾酮水平反映了人口平均数。 但是,大多数老年男性不愿意接受正常情况下年轻活力的丧失。 相反,我们建议,所有男性更有效的最佳水平应该在21至49岁男性参考范围的三分之一以上,并且任何补充都应将荷尔蒙水平恢复到该范围。当前研究的游离睾酮的最佳水平为20‒25 pg / mL。

在检测睾酮水平时,确定游离睾酮和总睾酮的水平是至关重要的,以了解任何观察到的缺乏症状的原因。55
由于设备标准化和实验室间可变性方面的困难,建议医师始终使用相同的本地实验室,并熟悉其所在社区提供的测定的准确性,准确性和正常值的定义。13
同样重要的是要记住,游离睾酮和总睾酮的血液水平在个体之间差异很大,因此很难建立一个通用的基线来规定一个标准化的治疗方案。 然而,个体内的水平是相当一致的,因此,随着时间的推移,男性必须进行多次检测,以确定治疗的趋势和个人阈值。
最后,在最初的检测中,也必须检测雌激素水平。男性荷尔蒙失衡的许多不良影响实际上是由相对于较低的睾酮水平(雌激素/睾酮比)升高的雌激素水平引起的。老年男性的寿命延长最佳雌激素水平(以雌二醇计)为20‒30 pg/mL。
一项发表在《美国医学协会(JAMA)》杂志上的研究,对501名慢性心力衰竭男性的血液雌二醇进行了测量。与五分之一雌激素平衡的男性相比,处于最高五分之一的男性(血清雌二醇水平为37.40pg/mL或更高)死亡率更高(133%)。 与平衡组相比,那些处于最低雌二醇水平(血清雌二醇水平低于12.90pg/mL)的人死亡率增加了317%。 在雌激素平衡的五分之一男性中,死亡人数最低的男性,其血清雌二醇水平在21.80到30.11pg/mL之间。56这是长期推荐男性客户应努力达到的理想范围。
我们在男性客户中发现的一个流行问题是游离睾酮不足,血清中的睾酮低于20‒25 pg / mL。当伴随着过量的雌二醇(超过30pg/mL的血清)时,这可以表明过量的芳香化酶活性。
最佳睾酮治疗通常需要医生的处方。 全科医生通常开生物一致性睾酮乳膏(可从复合药房获得)。传统的医生更有可能开处制药公司预先包装的睾酮贴剂和/或凝胶,这些公司已寻求FDA批准对其产品进行大规模商业化。
所有形式的生物一致性睾酮具有相同的分子结构,并且会增加血液中的游离睾酮和总睾酮。 主要的区别在于,预包装版本的每剂量可能比复合版本多10倍。

如果一个人选择睾酮治疗(口服或注射,皮下植入,外用霜,凝胶,或皮肤贴片),他应该记住几个事实和注意事项57,58:
·荷尔蒙更换不应在没有全面检测的情况下启动。
·随着时间的推移,多种荷尔蒙水平(如游离睾酮、总睾酮和雌激素)的模式和趋势决定了所需的特定荷尔蒙替代。
·如果不使用芳香化酶抑制补充剂或药物,以任何形式使用大量睾酮可能是不安全的。
·由于前列腺癌恶化的风险,在启动任何荷尔蒙替代疗法之前,必须进行仔细的筛查,包括直肠指检和前列腺特异性抗原(PSA)筛查。 然而,最近的研究表明,内源性睾酮水平低比高水平更有可能患前列腺癌。59,60然而,如果一个男人已经患了前列腺癌,那么应推迟睾酮的更换,直到根除潜在的癌症为止。
·打算通过处方或补充剂替代荷尔蒙的男性应与合格的医生紧密合作,制定合理的治疗方案,包括持续的监测和筛查。
·没有“一刀切”的治疗方法。每个体各不相同,荷尔蒙替代可以是简单或复杂的过程,通常需要仔细注意体征和症状以及实验室检查。
对于选择不使用(或建议不使用)荷尔蒙替代疗法的男性来说,营养素可以在旨在减少衰老对性荷尔蒙产生和代谢的影响的综合方案中发挥至关重要的作用。 以下是男性荷尔蒙整体恢复计划中的部分营养素清单。
锌。这种矿物质几乎参与了男性生殖的各个方面,包括睾酮代谢、精子形成和精子活力。61在一项对37名睾酮水平下降和相关精子数低的不孕男性的研究中,锌的有效性在这项研究中得到了证明。62这些男性每天服用60毫克锌,持续45-50天。 在大多数患者中,睾酮水平显著升高,平均精子数从800万增加到2000万。 一些男性需要更高水平的锌来充分抑制芳香化酶。
DHEA。DHEA是一种重要的荷尔蒙,随着年龄的增长而逐渐减少。632006年一项评估平均65岁男性补充脱氢表雄酮(DHEA)的研究发现,男性睾酮显著增加,低密度脂蛋白显著降低。64
蒺藜。蒺藜,又称刺藤,含有活性成分原薯蓣皂甙,据报道在体内转化为DHEA。65这种促进DHEA的活性可能解释了穿刺藤在其原产于欧洲和亚洲的催情剂的声誉。动物研究似乎证实了蒺藜改善性功能的能力。66,67
抗氧化剂。睾酮的产生可能随着年龄的增长而下降的原因之一是产生睾酮的组织中的氧化损伤。一项研究抗氧化剂在衰老男性男性荷尔蒙失衡中的作用的研究表明,抗氧化剂补充剂(包括维生素A和E,锌和硒)都支持睾酮的产生。68
菊花提取物。生物类黄酮化合物是一种天然芳香化酶抑制剂。69健美运动员使用菊花素作为睾酮促进补充,因为它最大限度地减少睾酮转化为雌激素。 尽管大黄素口服生物利用度低,70但与黑胡椒提取物胡椒碱合用可能会显着提高其生物利用度,从而增强其作为芳香化酶抑制剂的作用。71
槲皮素。一项研究表明,红酒抑制芳香化酶,从而抑制睾酮向雌激素的转化。 该研究将这种作用归因于槲皮素和其他成分。72
荨麻根。荨麻根提取物中含有的木质素可能有助于阻止性荷尔蒙结合球蛋白与睾酮的结合。 这可能有助于确保游离睾酮可用于促进男性活力和年轻的性功能。73,74荨麻根提取物被广泛使用,可与锯棕榈结合使用75或者单独76以缓解BPH症状。
鱼油。一项研究探讨了必需脂肪酸EPA和DHA如何影响43至88岁男性SHBG水平。77在对其他变量进行控制后,研究人员得出结论,EPA和DHA都降低了中老年男性SHBG的水平。
蛋白质。虽然充足的蛋白质消耗对维持肌肉质量至关重要,但在维持睾酮水平方面也很重要。 一项研究检查了饮食与SHBG之间的关系,发现40-70岁的男性低蛋白质饮食可能导致SHBG水平升高,从而降低睾酮的生物活性。78
玛卡。几个世纪以来,马卡一直被安第斯山脉的土著人民使用。 它是一种著名的催情剂和生育增强剂。 秘鲁研究人员对一小部分21-56岁的男性进行了随机、安慰剂对照、双盲研究。 结果表明,与安慰剂相比,玛卡改善了男性性欲的主观报告。 受试者食用1,500毫克或3,000毫克玛咖,或安慰剂,持续三个月。 八周后,服用玛咖的受试者的性欲得到改善。79,80
左旋肉碱。左旋肉碱是一种氨基酸衍生物,在患有雄荷尔蒙缺乏症引起的性功能障碍和抑郁症的老年男性中,其活性可能比睾酮更高。睾酮和肉碱都能改善性欲,性满足和夜间阴茎膨胀,但肉碱在改善勃起功能,夜间阴茎膨胀,性高潮和一般性健康方面比睾酮更有效。 左旋肉碱在治疗抑郁症方面也比睾酮更有效。81
吲哚-3-甲醇(I3C)。I3C可防止危险的雌激素代谢物和随后的前列腺癌。通过西兰花,球芽甘蓝和卷心菜等蔬菜或通过补充剂摄入足够的I3C可能对衰老的男性非常有用,如16-alphahydroxyestrone检查和降低他们的前列腺癌风险。研究表明,I3C增加了2-羟基雌酮与16-α-羟基雌酮的比例。 对男性来说,这很可能意味着降低了前列腺癌风险。82,83在一项检查前列腺癌的风险与雌激素代谢之间关系的研究中,,作者说,“这项病例对照研究的结果表明,雌激素代谢途径有利于2-羟基化而不是16-α-羟基化,可以降低临床上明显的前列腺癌的风险。”84
臀果木。一种来自非洲本土樱桃树Pygeumafricanum的树皮提取物,自1960年以来一直在欧洲用于治疗BPH,目前是法国最常用的治疗药物。85臀果木抗BPH作用的理论涉及通过抑制5-α-还原酶将睾酮转化为二氢睾酮(DHT),这是一种可能加剧BPH的有效睾酮代谢物。86最近的一项研究发现,N-丁苯磺酰胺(NBBS)是一种特异性雄荷尔蒙受体(AR)拮抗剂。 NBBS抑制AR和孕酮受体(PR)介导的反式激活,抑制人类前列腺癌细胞内源性PSA的表达和生长。87
锯棕榈。在欧洲,锯棕榈(Serenoa Repens)已被广泛用作减轻BPH症状的药物。 锯棕榈具有多种作用机制:抑制5-α-还原酶;抑制DHT与雄荷尔蒙受体的结合;减少前列腺生长的炎症成分(通过抑制COX-2和一种称为5-脂氧合酶的酶);诱导凋亡和抑制前列腺细胞增殖。88-91它对前列腺增大的临床益处包括减少夜间尿急,92减少膀胱残余尿量,93和减少排尿症状带来的不适。94
历史上,医学专业人士怀疑睾酮替代治疗会增加前列腺癌进展和复发的风险。98这种担心使医师成为避免在性腺功能减退的男性患者中避免睾酮替代疗法的标准做法。
不过,值得注意的是,在许多情况下似乎是相反的-较低水平的内源性睾酮比较高水平更有可能患前列腺癌。95美国国立卫生研究院(National Institutes of Health)的一项研究表明,在年龄增长的男性中,“高睾酮水平与前列腺癌风险增加无关,低睾酮水平对前列腺癌也没有保护作用。”59
一项来自18项前瞻性研究的数据回顾比较了3886名前列腺癌男性和6438名健康对照者的雄荷尔蒙和雌激素血清浓度。结果表明,前列腺癌的风险与性荷尔蒙水平之间没有显着关联。602020年发表的一项大型队列研究支持睾酮治疗的安全性。 对近7万例接受过放疗或手术治疗的非转移性前列腺癌病史的患者进行分析后发现,那些随后接受睾酮治疗的患者没有增加癌症复发或死亡的风险。98
在500多名被诊断患有前列腺癌的男性中(随访时间超过8.7年),高雄性荷尔蒙水平与侵袭性前列腺疾病的风险降低有关,而非侵袭性疾病的风险没有变化。 总之,任何类固醇荷尔蒙水平(雌二醇除外)与侵袭性前列腺癌的风险无关。96
哈佛医学院的临床副教授亚伯拉罕·莫金塔勒(AbrahamMorgentaler)在他的《生命中的睾酮》一书中令人信服地阐述了高睾酮水平的一处和安全性与低睾酮的危险性。 他还回顾了最初的1941年诺贝尔奖得主97,99关于睾酮的研究,并展示了这些数据在70多年的时间里一直被误解和质疑 。
·睾酮是男性的主要荷尔蒙,对性欲和勃起功能至关重要,在情绪、能量、骨骼健康和身体成分中起着至关重要的作用。
·睾酮水平随着年龄的增长而下降,通常从30多岁开始,睾酮水平的下降与抑郁症、疲劳、肥胖和认知能力下降等疾病有关。
·男性睾酮水平低与代谢综合征密切相关,可能是2型糖尿病和心血管疾病的危险因素。
·将睾酮恢复到年轻水平会给男性带来很多健康益处,包括对心脏健康、身体成分、情绪和记忆的益处。
·生物一致性睾酮尚未被发现对健康的前列腺有不良影响,实际上,它可能有助于改善低睾酮水平的男性的前列腺症状。 睾酮治疗在前列腺癌患者中是禁忌的。
·定期的血液检测可以帮助你和你的医生决定睾酮治疗是否适合你。 优化睾酮水平需要采取多管齐下的方法,其中包括最佳饮食,适当的营养,营养补充剂,锻炼和与生物一致性睾酮。
参考文献
1.Miner MM, Seftel AD. Testosterone and ageing: what have we learned since the Institute of Medicine report and what lies ahead? Int J Clin Pract. 2007 Apr;61(4):622-32.
2.Malkin C., Pugh P., Morris P., et al. Coronary artery disease: Low serum testosterone and increased mortality in men with coronary heart disease. Heart 2010; 96:1821-1825.
3.Kapoor D, Goodwin E, Channer KS, et al. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity, and hypercholesterolaemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol 2006;154:899e906.
4.Malkin CJ, Pugh PJ, Jones RD, et al. The effect of testosterone replacement on endogenous inflammatory cytokines and lipid profiles in hypogonadal men. J Clin Endocrinol Metab 2004;89:3313e18.
5.Heufelder AE, Saad F, Bunck MC, et al. 52-Week treatment with diet and exercise plus transdermal testosterone reverses the metabolic syndrome and improves glycaemic control in men with newly diagnosed type 2 diabetes and subnormal plasma testosterone. J Androl 2009;30:726e33.
6.Fukui M, Kitagawa Y, Ose H, Hasegawa G, Yoshikawa T, Nakamura N. Role of endogenous androgen against insulin resistance and athero- sclerosis in men with type 2 diabetes. Curr Diabetes Rev. 2007 Feb;3(1):25-31.
7.Malkin CJ, Jones TH, Channer KS. The effect of testosterone on insulin sensitivity in men with heart failure. Eur J Heart Fail 2007;9:44e50.
8.Mah P. M. and Wittert G. A. "Obesity and testicular function,"Molecular and Cellular Endocrinology, vol. 316, no.2, pp. 180–186, 2010.
9.Goncharov N. P., Katsya G. V., Chagina N. A., and Gooren L. J. "Testosterone and obesity in men under the age of 40 years," Andrologia, vol. 41, no. 2, pp. 76–83, 2009.
10.Kalyani RR, Dobs AS. Androgen deficiency, diabetes, and the metabolic syndrome in men. Cur Opin in Endocrinol Diab Obesity 2007; 14: 226-234.
11.Cohen PG. The hypogonadal-obesity cycle: role of aromatase in modulating the testosterone-estradiol shunt—a major factor in the genesis of morbid obesity. Med Hypotheses. Jan 1999;52(1):49-51.
12.Tishova Y, Kalinchenko SY. Breaking the vicious circle of obesity: the metabolic syndrome and low testosterone by administration of testosterone to a young man with morbid obesity. Arq Bras Endocrinol Metabol. 2009 Nov;53(8):1047-51.
13.Morales A, Bella AJ, Chun S, Lee J, Assimakopoulos P, Bebb R, Gottesman I, Alarie P, Dugré H, Elliott S. A practical guide to diagnosis, management and treatment of testosterone deficiency for Canadian physicians. Can Urol Assoc J. 2010 Aug;4(4):269-75.
14.Henry A. Feldman, Christopher Longcope, Carol A. Derby, Catherine B. Johannes, Andre B. Araujo, Andrea D. Coviello, William J. Bremner and John B. McKinlay Age Trends in the Level of Serum Testosterone and Other Hormones in Middle-Aged Men: Longitudinal Results from the Massachusetts Male Aging Study. The Journal of Clinical Endocrinology & Metabolism Vol. 87, No. 2 589-598, 2002.
15.Lapauw B, Goemaere S, Zmierczak H, Van Pottelbergh H, Mahmoud A, Y Taes, De Bacquer D, Vansteelandt S and Kaufman JM: The decline of serum testosterone levels in community-dwelling men over 70 years of age: descriptive data and predictors of longitudinal changes. European Journal of Endocrinology (2008) 159 459–468
16.Naharci MI, Pinar M, Bolu E, Olgun A. Effect of testosterone on insulin sensitivity in men with idiopathic hypogonadotropic hypogonadism. Endocr Pract. 2007 Oct;13(6):629-35.
17.Saad F, Gooren L, Haider A, et al. An exploratory study of the effects of 12 month administration of the novel long-acting testosterone undecanoate on measures of sexual function and the metabolic syndrome. Arch Androl. 2007;53(6):353-7.
18.Allan CA, Strauss BJ, McLachlan RI. Body composition, metabolic syndrome, and testosterone in aging men. Int J Impot Res. 2007 Sep;19(5):448-57.
19.Pergola C et al. Testosterone suppresses phospholipase D, causing sex differences in leukotriene biosynthesis in human monocytes. FASEB J. 2011 Jun 21. [Epub ahead of print]
20.Parlapiano C et al. he relationship between glycated hemoglobin and polymorphonuclear leukocyte leukotriene B4 release in people with diabetes mellitus. Diabetes Res Clin Pract. 1999 Oct;46(1):43-5.
21.Riccioni G et al. Leukotrienes and atherosclerosis. Curr Drug Targets. 2010 Jul;11(7):882-7.
22.Kalinchenko SY et al. Effects of testosterone supplementation on markers of the metabolic syndrome and inflammation in hypogonadal men with the metabolic syndrome: the double-blinded placebo-controlled Moscow study. Clin Endocrinol (Oxf). 2010 Nov;73(5):602-12. doi: 10.1111/j.1365-2265.2010.03845.x.
23.Coutinho T et al. Central obesity and survival in subjects with coronary artery disease: a systematic review of the literature and collaborative analysis with individual subject data. J Am Coll Cardiol. 2011 May 10;57(19):1877-86.
24.Tok EC, Ertunc D, Oz U, Camdeviren H, Ozdemir G, Dilek S. The effect of circulating androgens on bone mineral density in postmenopausal women. Maturitas. Jul 15 2004;48(3):235-42.
25.Valimaki VV, Alfthan H, Ivaska KK, et al. Serum estradiol, testosterone, and sex hormone-binding globulin as regulators of peak bone mass and bone turnover rate in young Finnish men. J Clin Endocrinol Metab. Aug 2004;89(8):3785-9.
26.Kenny AM, Kleppinger A, Annis K, Rathier M, Browner B, Judge JO, McGee D. Effects of transdermal testosterone on bone and muscle in older men with low bioavailable testosterone levels, low bone mass, and physical frailty. J Am Geriatr Soc. 2010 Jun;58(6):1134-43.
27.Herbst KL, Bhasin S. Testosterone action on skeletal muscle. Curr Opin Clin Nutr Metab Care. May 2004;7(3):271-7.
28.Almeida OP, Yeap BB, Hankey GJ, Jamrozik K, Flicker L. Low free testosterone concentration as a potentially treatable cause of depressive symptoms in older men. Arch Gen Psychiatry. 2008 Mar;65(3):283-9.-7.
29.Morley JE. Testosterone and behavior. Clin Geriatr Med. Aug 2003;19(3):605-16.
30.Carnahan RM, Perry PJ. Depression in aging men: the role of testosterone. Drugs Aging. 2004;21(6):361-376.
31.Orengo CA, Fullerton G, Tan R. Male depression: a review of gender concerns and testosterone therapy. Geriatrics. Oct 2004;59(10):24-30.
32.Cherrier MM, Plymate S, Mohan S, et al. Relationship between testosterone supplementation and insulin-like growth factor-I levels and cognition in healthy older men. Psychoneuroendocrinology. Jan 2004;29(1):65-82.
33.Moffat SD, Zonderman AB, Metter EJ, Blackman MR, Harman SM, Resnick SM. Longitudinal assessment of serum free testosterone concentration predicts memory performance and cognitive status in elderly men. J Clin Endocrinol Metab. Nov 2002;87(11):5001-7.
34.Salminen EK, Portin RI, Koskinen A, Helenius H, Nurmi M. Associations between serum testosterone fall and cognitive function in prostate cancer patients. Clin Cancer Res. Nov 15 2004;10(22):7575-82.
35.Ahlbom E, Prins GS, Ceccatelli S. Testosterone protects cerebellar granule cells from oxidative stress-induced celldeath through a receptor mediated mechanism. Brain Res. Feb 23 2001;892(2):255-62.
36.Pike JG., Carroll JC,, Rosario ER., Barron A. Protective actions of sex steroid hormones in Alzheimer's disease. Front Neuroendocrinol. 2009 July ; 30(2): 239–258.
37.Zhang Y, Champagne N, Beitel LK, Goodyer CG, Trifiro M, LeBlanc A. Estrogen and androgen protection of human neurons against intracellular amyloid beta1-42 toxicity through heat shock protein 70. J Neurosci. Jun 9 2004;24(23):5315-21.
38.Rosario ER, Pike CJ. Androgen regulation of beta-amyloid protein and the risk of Alzheimer's disease. Brain Res Rev 2008;57:444–453.
39.Hogervorst E, Bandelow S, Combrinck M, Smith AD. Low free testosterone is an independent risk factor for Alzheimer's disease. Exp Gerontol. Nov-Dec 2004;39(11-12):1633-39.
40.Ready RE, Friedman J, Grace J, Fernandez H. Testosterone deficiency and apathy in Parkinson's disease: a pilot study. J Neurol Neurosurg Psychiatry. Sep 2004;75(9):1323-26.
41.Moffat SD, Zonderman AB, Metter EJ, Kawas C, Blackman MR, Harman SM, Resnick SM. Free testosterone and risk for Alzheimer disease in older men. Neurology. 2004;62:188-193.
42.Rosario ER, Chang L, Stanczyk FZ, et al. Age-related testosterone depletion and the development of Alzheimer disease. JAMA. 2004 Sep;292(12):1431-2.
43.Tan RS, Pu SJ. A pilot study on the effects of testosterone in hypogonadal aging male patients with Alzheimer's disease. Aging Male 2003;6:13.
44.Saad F, Gooren LJ, Haider A, Yassin A. A dose-response study of testosterone on sexual dysfunction and features of the metabolic syndrome using testosterone gel and parenteral testosterone undecanoate. J Androl. 2008 Jan-Feb;29(1):102-5.
45.Pitteloud N, Mootha VK, Dwyer AA, Hardin M, Lee H, Eriksson KF, Tripathy D, Yialamas M, Groop L, Elahi D, Hayes FJ. Relationship between testosterone levels, insulin sensitivity, and mitochondrial function in men. Diabetes Care. 2005 Jul;28(7):1636-42.
46.Saad F. and Gooren L, "The role of testosterone in the metabolic syndrome: a review," Journal of Steroid Biochemistry and Molecular Biology, vol. 114, no. 1-2, pp. 40–43, 2009.
47.Stanworth R. D. and Jones T. H., "Testosterone in obesity, metabolic syndrome and type 2 diabetes," Frontiers of Hormone Research, vol. 37, pp. 74–90, 2009.
48.Selvin E., Feinleib M., Zhang L. et al., "Androgens and diabetes in men: results from the third National Health and Nutrition Examination Survey (NHANES III)," Diabetes Care, vol. 30, no. 2, pp. 234–238, 2007.
49.Jones RD, Nettleship JE, Kapoor D, et al. Testosterone and atherosclerosis in aging men: purported association and clinical implications. Am J Cardiovasc Drugs 2005;5:141e54.
50.Shibata Y, Ito K, Nakano K, et al. Changes in the endocrine environment of the human prostate transition zone with aging: simultaneous quantitative analysis of prostatic sex steroids and comparison with human prostatic histological composition. Prostate. 2000 Jan;42(1):45-55.
51.Gann PH, Hennekens CH, Longcope C, et al. A prospective study of plasma hormone levels, nonhormonal factors, and development of benign prostatic hyperplasia. Prostate. 1995 Jan;26(1):40-9.
52.Krieg M, Weisser H, Tunn S. [Androgen and estrogen metabolism in human benign prostatic hyperplasia (BPH)]. [Article in German]. Verh Dtsch Ges Pathol. 1993;77:19-24.
53.Pechersky AV, Mazurov VI, Semiglazov VF, et al. Androgen administration in middle-aged and ageing men: effects of oral testosterone undecanoate on dihydrotestosterone, oestradiol and prostate volume. Int J Androl. 2002 Apr;25(2):119-25.
54.Dzugan SA, Arnold Smith R. Hypercholesterolemia treatment: a new hypothesis or just an accident? Med Hypotheses. 2002 Dec;59(6):751-6.
55.Khosla S, Amin S, Singh RJ, Atkinson EJ, Melton LJ 3rd, Riggs BL. Comparison of sex steroid measurements in men by immunoassay versus mass spectroscopy and relationships with cortical and trabecular volumetric bone mineral density. Osteoporos Int. 2008 Oct;19(10):1465-71.
56.Ewa A. Jankowska; Piotr Rozentryt; Beata Ponikowska; et al. Circulating estradiol and mortality in men with systolic chronic heart failure. JAMA. 2009 May 13;301(18):1892-901.
57.Schaeffer EM, Walsh PC. Risks of testosterone replacement. N Engl J Med. May 6 2004;350(19):2004-06.
58.Cunningham GR, Toma SM. Why Is Androgen Replacement in Males Controversial? J Clin Endocrinol Metab. 2010 Sep 29. [Epub ahead of print doi:10.1210/jc.2010-0266]
59.Morgentaler A. Testosterone replacement therapy and prostate risks: where's the beef? Can J Urol. Feb 2006;13 Suppl 1:40-3.
60.Roddam AW, Allen NE, Appleby P, Key TJ. Endogenous sex hormones and prostate cancer: a collaborative analysis of 18 prospective studies. J Natl Cancer Inst. Feb 6 2008;100(3):170-83.
61.Ali H, Baig M, Rana MF, Ali M, Qasim R, Khem AK. Relationship of serum and seminal plasma zinc levels and serum testosterone in oligospermic and azoospermic infertile men. J Coll Physicians Surg Pak. Nov 2005;15(11):671-3.
62.Netter A, Hartoma R, Nahoul K. Effect of zinc administration on plasma testosterone, dihydrotestosterone, and sperm count. Arch Androl. 1981 Aug;7(1):69-73.
63.Basar MM, Aydin G et al. Relationship between serum sex steroids and Aging Male Symptoms score and International Index of Erectile Function. Urology. 2005 Sep;66(3):597–601.
64.Martina V, Benso A, Gigliardi VR, Masha A, Origlia C, Granata R, Ghigo E. Short-term dehydroepiandrosterone treatment increases platelet cGMP production in elderly male subjects. Clin Endocrinol (Oxf). 2006 Mar;64(3):260-4.
65.Adimoelja A. Phytochemicals and the breakthrough of traditional herbs in the management of sexual dysfunctions. Int J Androl. 2000, 23 Suppl 2:82–4.
66.Gauthaman K, Ganesan AP, et al. Sexual effects of puncture vine (Tribulus terrestris) extract (protodioscin): An evaluation using a rat model. J Altern Complement Med. 2003 Apr;9(2):257–65.
67.Milasius K, Dadeliene R, Skernevicius J. The influence of the Tribulus terrestris extract on the parameters of the functional preparedness and athletes' organism homeostasis. Fiziol Zh. 2009;55(5):89-96.
68.He F, Feng L. [Effects of some micronutrients on partial androgen deficiency in the aging male]. Zhonghua Nan Ke Xue. Oct 2005;11(10):784-6.
69.Kellis JT, Jr., Vickery LE. Inhibition of human estrogen synthetase (aromatase) by flavones. Science. Sep 7 1984;225(4666):1032-4.
70.Walle T, Otake Y, Brubaker JA, Walle UK, Halushka PV. Disposition and metabolism of the flavonoid chrysin in normal volunteers. Br J Clin Pharmacol. 2001 Feb;51(2):143-6.
71.Srinivasan K. Black pepper and its pungent principle-piperine: a review of diverse physiological effects. Crit Rev Food Sci Nutr. 2007;47(8):735-48.
72.Eng ET, Williams D, Mandava U, Kirma N, Tekmal RR, Chen S. Anti-aromatase chemicals in red wine. Ann N Y Acad Sci. Jun 2002;963:239-46.
73.Schöttner M, Gansser D, Spiteller G. Lignans from the roots of Urtica dioica and their metabolites bind to human sex hormone binding globulin (SHBG). Planta Med. 1997 Dec;63(6):529-32.
74.Chrubasik JE, Roufogalis BD, Wagner H, Chrubasik S. A comprehensive review on the stinging nettle effect and efficacy profiles. Part II: urticae radix. Phytomedicine. 2007 Aug;14(7-8):568-79.
75.Lopatkin N, Sivkov A, Walther C, et al. Long-term efficacy and safety of a combination of sabal and urtica extract for lower urinary tract symptoms--a placebo-controlled, double-blind, multicenter trial. World J Urol. Jun 2005;23(2):139-46.
76.Safarinejad MR. Urtica dioica for treatment of benign prostatic hyperplasia: a prospective, randomized, double-blind, placebo-controlled crossover study. J Herb Pharmacother. 2005;5(4):1-11.
77.Nagata C, Takatsuka N, Kawakami N, Shimizu H. Relationships between types of fat consumed and serum estrogen and androgen concentrations in Japanese men. Nutr Cancer. 2000;38(2):163-67.
78.Longcope C, Feldman HA, Mc Kinlay JB, Araujo AB. Diet and sex hormone-binding globulin. J Clin Endocrinol Metab. 2000 Jan; 85(1):293-6.
79.Waynberg J. Aphrodisiacs: Contributions to the clinical evaluation of the traditional use of Ptychopetalum. First International Congress on Ethnopharmacology. France; June 1990.
80.Gonzales GF, Cordova A, Vega K, et al. Effect of Lepidium meyenii (MACA) on sexual desire and its absent relationship with serum testosterone levels in adult healthy men. Andrologia. 2002 Dec;34(6):367-72.
81.Cavallini G, Caracciolo S, Vitali G, Modenini F, Biagiotti G. Carnitine versus androgen administration in the treatment of sexual dysfunction, depressed mood, and fatigue associated with male aging. Urology. Apr 2004;63(4):641-6.
82.Sepkovic DW, Bradlow HL, Bell M. Quantitative determination of 3,3'-diindolylmethane in urine of individuals receiving indole-3-carbinol. Nutr Cancer. 2001;41(1-2):57-63.
83.Bradlow HL. Review. Indole-3-carbinol as a chemoprotective agent in breast and prostate cancer. In Vivo. 2008 Jul-Aug;22(4):441-5.
84.Muti P, Westerlind K, Wu T, et al. Urinary estrogen metabolites and prostate cancer: a case-control study in the United States. Cancer Causes Control. 2002 Dec;13(10): 947-55.
85.Buck AC. Is there a scientific basis for the therapeutic effects of serenoa repens in benign prostatic hyperplasia? J Urol. 2004 Nov;172(5 Pt 1):1792-9.
86.Wilt T, Ishani A, Mac Donald R, Rutks I, Stark G. Pygeum africanum for benign prostatic hyperplasia. Cochrane Database Syst Rev. 2002;(1):CD001044.
87.Papaioannou M, Schleich S, Roell D, Schubert U, Tanner T, Claessens F, Matusch R, Baniahmad A. NBBS isolated from Pygeum africanum bark exhibits androgen antagonistic activity, inhibits AR nuclear translocation and prostate cancer cell growth. Invest New Drugs. 2010 Dec;28(6):729-43. Epub 2009 Sep 23.
88.Debruyne F, Koch G et al. Comparison of a phytotherapeutic agent (Permixon) with an alpha-blocker (Tamsulosin) in the treatment of benign prostatic hyperplasia: a 1-year randomized international study. Eur Urol. 2002 May;41(5):497-506.
89.Goldmann WH, Sharma AL, Currier SJ, Johnston PD, Rana A, Sharma CP. Saw palmetto berry extract inhibits cell growth and Cox-2 expression in prostatic cancer cells. Cell Biol Int. 2001,25(11):1117-24.
90.Paubert-Braquet M, Mencia Huerta JM, Cousse H, Braquet P. Effect of the lipidic lipidosterolic extract of Serenoa repens (Permixon) on the ionophore A23187-stimulated production of leukotriene B4 (LTB4) from human polymorphonuclear neutrophils. Prostaglandins Leukot Essent Fatty Acids. 1997 Sep;57(3):299-304.
91.Vacherot F, Azzouz M, Gil-Diez-De-Medina S, Colombel M, De La Taille A, Lefrère Belda MA, Abbou CC, Raynaud JP, Chopin DK. Induction of apoptosis and inhibition of cell proliferation by the lipido-sterolic extract of Serenoa repens (LSESr, Permixon in benign prostatic hyperplasia. Prostate. 2000 Nov 1;45(3):259-66.
92.Pavone C, Abbadessa D, Tarantino ML, Oxenius I, Laganà A, Lupo A, Rinella M. Associating Serenoa repens, Urtica dioica and Pinus pinaster. Safety and efficacy in the treatment of lower urinary tract symptoms. Prospective study on 320 patients. Urologia. 2010 Sep 23;77(1):43-51.
93.Giannakopoulos X, Baltogiannis D, Giannakis D, Tasos A, Sofikitis N, Charalabopoulos K, Evangelou A. The lipidosterolic extract of Serenoa repens in the treatment of benign prostatic hyperplasia: a comparison of two dosage regimens. Adv Ther. 2002 Nov-Dec;19(6):285-96.
94.Mantovani F. Serenoa repens in benign prostatic hypertrophy: analysis of 2 Italian studies. Minerva Urol Nefrol. 2010 Dec;62(4):335-40.
95.Morgentaler A. Testosterone for Life. New York: McGraw Hill; 2009.
96.Severi G, Morris HA, MacInnis RJ, English DR, Tilley W, Hopper JL, Boyle P, Giles GG. Circulating steroid hormones and the risk of prostate cancer. Cancer Epidemiol Biomarkers Prev. 2006 Jan;15(1):86-91.
97.Huggins C, Stevens R, Hodges C. The effects of castration on advanced carcinoma of the prostate gland. Archives of Surgery. 1941;43:209.
98.Sarkar RR, Patel SH, Parsons JK, et al. Testosterone therapy does not increase the risks of prostate cancer recurrence or death after definitive treatment for localized disease.Prostate cancer and prostatic diseases.2020.
99.Saad F, Haider A, Haider KS, Doros G, Traish A. Long-term therapy with testosterone undecanoate injections (TU) results in profound and sustained weight loss over 11 years in obese men with hypogonadism: real-world data from a registry study.